| |||
| |||
| Adlandırmalar | |||
|---|---|---|---|
Tercih edilen IUPAC adı Bütan[1] | |||
Tetrakarban[1] (tavsiye edilmez) | |||
| Tanımlayıcılar | |||
3D model (JSmol)
|
|||
| 969129 | |||
| ChEBI | |||
| ChEMBL | |||
| ChemSpider | |||
| ECHA InfoCard | 100.003.136 | ||
| EC Numarası |
| ||
| E numaraları | E943a (parlatıcılar, ...) | ||
| 1148 | |||
| KEGG | |||
| MeSH | butane | ||
PubChem CID
|
|||
| RTECS numarası |
| ||
| UNII | |||
| UN numarası | 1011 | ||
CompTox Bilgi Panosu (EPA)
|
|||
| |||
| Özellikler | |||
| Kimyasal formül | C4H10 | ||
| Molekül kütlesi | 58,12 g mol−1 | ||
| Görünüm | renksiz gaz | ||
| Yoğunluk | 2,48 kg/m3 (15 °C (59 °F)) | ||
| Erime noktası | -140 ila -134 °C; -220 ila -209 °F; 133 ila 139 K | ||
| Kaynama noktası | -1 ila 1 °C; 30 ila 34 °F; 272 ila 274 K | ||
| Çözünürlük (su içinde) | 61 mg/L ( 20 °C (68 °F)) | ||
| log P | 2.745 | ||
| Buhar basıncı | ~170 kPa (283 K) [4] | ||
Henry yasası
sabiti (kH) |
11 nmol Pa−1 kg−1 | ||
| −57.4·10−6 cm3/mol | |||
| Termokimya | |||
Isı sığası (C)
|
98.49 J/(K·mol) | ||
Standart formasyon entalpisi (ΔfH⦵298)
|
−126.3–−124.9 kJ/mol | ||
Standart yanma entalpisi (ΔcH⦵298)
|
−2.8781–−2.8769 MJ/mol | ||
| Tehlikeler | |||
| GHS etiketleme sistemi: | |||
| Piktogramlar |  
| ||
| İşaret sözcüğü | DANGER | ||
| Tehlike ifadeleri | H220 | ||
| Önlem ifadeleri | P210 | ||
| NFPA 704 (yangın karosu) |
|||
| Parlama noktası | [dönüştürme: geçersiz sayı] | ||
| 405 °C (761 °F; 678 K) | |||
| Patlama sınırları | 1.8–8.4% | ||
| NIOSH ABD maruz kalma limitleri: | |||
| PEL (izin verilen) | none[2] | ||
| REL (tavsiye edilen) | TWA 800 ppm (1900 mg/m3)[2] | ||
| IDLH (anında tehlike) | 1600 ppm[2] | ||
| Benzeyen bileşikler | |||
Benzeyen alkanes
|
|||
Benzeyen bileşikler
|
Perflorobütan | ||
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa).
| |||
| Bilgi kutusu kaynakları | |||
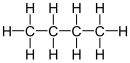
Bütan, (ya da n-bütan) dört karbon atomu içeren dalsız bir bileşiktir: CH3CH2CH2CH3. İzobütan (i-bütan, 2-metilpropan) bütanın izomeridir, CH3CH(CH3)2. Normal şartlar altında bütan; aşırı yanıcı, renksiz ve kolay sıvılaşan bir gazdır.
Tepkimeleri ve kullanımı
[değiştir | kaynağı değiştir]Bol oksijenli ortamlarda, bütan yanar ve karbondioksitle su buharı oluşturur:
bütan + oksijen → su * karbondioksit + su buharı
Oksijenin sınırlı olduğu durumlardaysa, karbon (tortu halinde) ya da karbonmonoksit de oluşabilir.

Bütan gazı tüp içinde satılır ve propan ile birlikte LPG ya da tüpgaz olarak adlandırılır. Ayrıca çakmaklarda yakıt olarak ve sprey ürünlerde itici gaz olarak kullanılır.
Sağlık üzerindeki etkileri
[değiştir | kaynağı değiştir]Bütan, doğrudan yüksek basınçlı bir kaptan olunması öfori, uyuşukluk, bilinç kaybı, asfiksi, kalp aritmisi, kan basıncında dalgalanmalar ve geçici hafıza kaybına neden olabilir ve asfiksi ve ventriküler fibrilasyondan ölüme yol açabilir. Bütan kan dolaşımına girer ve saniyeler içinde etki gösterir.[5] Bütan doğrudan boğaza püskürtüldüğünde sıvı hızla genleşerek -20 °C'ye (-4 °F) kadar soğuyabilir ve uzun süreli bir laringospazma sebep olabilir.[6]
Bütan, İngiltere'de en sık kötüye kullanılan uçucu maddedir ve 2000 yılındaki solvent kaynaklı ölümlerin %52'sinin nedenidir.[7]
Kaynakça
[değiştir | kaynağı değiştir]Kaynakça
[değiştir | kaynağı değiştir]- ^ a b "Front Matter". Nomenclature of Organic Chemistry: IUPAC Recommendations and Preferred Names 2013 (Blue Book). Cambridge: The Royal Society of Chemistry. 2014. s. 4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Similarly, the retained names 'ethane', 'propane', and 'butane' were never replaced by systematic names 'dicarbane', 'tricarbane', and 'tetracarbane' as recommended for analogues of silane, 'disilane'; phosphane, 'triphosphane'; and sulfane, 'tetrasulfane'.
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0068". National Institute for Occupational Safety and Health (NIOSH).
- ^ August Wilhelm Von Hofmann (1867). "I. On the action of trichloride of phosphorus on the salts of the aromatic monamines". Proceedings of the Royal Society of London. 15: 54-62. doi:10.1098/rspl.1866.0018. 1 Aralık 2023 tarihinde kaynağından arşivlendi10 Ocak 2024.
- ^ W. B. Kay (1940). "Pressure-Volume-Temperature Relations for n-Butane". Industrial & Engineering Chemistry. 32 (3): 358-360. doi:10.1021/ie50363a016.
- ^ "Neurotoxic Effects from Butane Gas". thcfarmer.com. 19 Aralık 2009. 5 Ekim 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Ekim 2016.
- ^ Ramsey J, Anderson HR, Bloor K (1989). "An introduction to the practice, prevalence and chemical toxicology of volatile substance abuse". Hum Toxicol. 8 (4): 261-269. doi:10.1177/096032718900800403. PMID 2777265.
- ^ Field-Smith M, Bland JM, Taylor JC. "Trends in death Associated with Abuse of Volatile Substances 1971–2004" (PDF). Department of Public Health Sciences. London: St George’s Medical School. 27 Mart 2007 tarihinde kaynağından (PDF) arşivlendi.