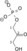| Pamilija fosfoglicerat mutaza |
|---|
| Identifikatori |
|---|
| Simbol | PGAM |
|---|
| Pfam | PF00300 |
|---|
| InterPro | IPR013078 |
|---|
| PROSITE | PDOC00158 |
|---|
| SCOP | 3pgm |
|---|
| SUPERFAMILY | 3pgm |
|---|
| Dostupne proteinske strukture: |
|---|
| Pfam | structures |
|---|
| PDB | RCSB PDB; PDBe; PDBj |
|---|
| PDBsum | structure summary |
|---|
|
| Fosfoglicerat mutaza 1 (mozak) |
|---|
| Identifikatori |
|---|
| Simbol | PGAM1 |
|---|
| Alt. simboli | PGAMA |
|---|
| Entrez | 5223 |
|---|
| HUGO | 8888 |
|---|
| OMIM | 172250 |
|---|
| RefSeq | NM_002629 |
|---|
| UniProt | P18669 |
|---|
| Ostali podaci |
|---|
| EC broj | 5.4.2.1 |
|---|
| Lokus | Hromozom 10 q25.3 |
|---|
| Fosfoglicerat mutaza 2 (mišeći) |
|---|
| Identifikatori |
|---|
| Simbol | PGAM2 |
|---|
| Entrez | 5224 |
|---|
| HUGO | 8889 |
|---|
| OMIM | 261670 |
|---|
| RefSeq | NM_000290 |
|---|
| UniProt | P15259 |
|---|
| Ostali podaci |
|---|
| EC broj | 5.4.2.1 |
|---|
| Lokus | Hromozom 7 p13-p12 |
|---|
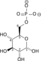
Fosfoglicerat mutaza (PGM) je enzim koji katalizuje osmi korak glikolize. On katalizuje interni transfer fosfatne grupe sa C-3 na C-2, što dovodi do konverzije 3-fosfoglicerata (3PG) u 2-fosfoglicerat (2PG) putem 2,3-bisfosfogliceratnog intermedijera.[1]
Mehanizam
Fosfoglicerat mutaza je izomeraza. Ona prenosi fosfatnu grupu (PO32-) sa C-3 ugljenika 3-fosfoglicerata na C-2 ugljenik, formirajuči 2-fosfoglicerat. U reakciji učestvuju dve zasebne fosfatne grupe i krajnji fosfat na 2-ugljeniku nije fosfat koji je uklonjen sa 3-ugljenika.
U inicijalnom stanju enzima, aktivno mesto sadrži fosfohistidinski kompleks formiran fosforilacijom specifičnog histidinskog ostatka. Kad 3-fosfoglicerat uđe u aktivno mesto, fosfohistidinski kompleks je pozicioniran tako da olakša transfer fosfata sa enzima na C-2 atom supstrata, formirajući 2,3-bisfosfogliceratni intermedijar.
Defosforilacija enzimskog histidina aktivira lokalnu alosternu promenu u enzimskoj konfiguraciji koja sad poravnava supstratovu 3-C fosfatnu grupu sa histidinom aktivnog mesta enzima i olakšava tresfer fosfata, vraćajući enzim u njegovo inicijalno fosforilisano stanje, dok se produkt, 2-fosfoglicerat, otpušta.
Reakcija
- 3PG + P-Enzim → 2,3BPG + Enzim → 2PG + P-Enzim
ΔG°′=+1,1 kcal/mol
Ljudski proteini koji sadrže ovaj domen
BPGM; PFKFB1; PFKFB2; PFKFB3; PFKFB4; PGAM1; PGAM2; PGAM4; PGAM5; STS1; UBASH3A;
Reference
- ^ Linda A Fothergill-Gillmore, Herman C Watson. „The phosphoglycerate mutases”. Ур.: Alton Meister. Advances in Enzymology and Related Areas of Molecular Biology.
Literatura
- Nicholas C. Price; Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third изд.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 изд.). Wiley-Interscience. ISBN 0471205036.
- Branden C; Tooze J. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 изд.). Wiley Classics Library. ISBN 0471303097.
- William P. Jencks (1987). Catalysis in Chemistry and Enzymology. Dover Publications. ISBN 0486654605.
Spoljašnje veze
- Phosphoglycerate+Mutase на US National Library of Medicine Medical Subject Headings (MeSH)
|
| mt, a/u/y/n/h,r/g/c/p/i,f/s/l/o,m,e,t | au/u/n/h,rgcp/i,f/s/l/o,m, epon | med(A16,C10),med(a/ur/y/n/h,r/g/c/p/i,f/s/o,e,t) |
|
|
|
|---|
| Glikoliza | |
|---|
| Glukoneogeneza | |
|---|
| Regulatorni | |
|---|
|
|---|
| Teme | |
|---|
| Tipovi | |
|---|
- B enzm: 1.1/2/3/4/5/6/7/8/10/11/13/14/15-18, 2.1/2/3/4/5/6/7/8, 2.7.10, 2.7.11-12, 3.1/2/3/4/5/6/7, 3.1.3.48, 3.4.21/22/23/24, 4.1/2/3/4/5/6, 5.1/2/3/4/99, 6.1-3/4/5-6
|
Portali: Molekularna i ćelijska biologija
Molekularna i ćelijska biologija Hemija
Hemija