Reaksi dehidrasi
Reaksi dehidrasi dalam ilmu kimia biasanya didefinisikan sebagai reaksi yang melibatkan pelepasan air dari molekul yang bereaksi. Reaksi dehidrasi merupakan subset dari reaksi eliminasi. Karena gugus hidroksil (-OH) adalah gugus lepas yang buruk, pemberian katalis asam Brønsted sering kali membantu protonasi gugus hidroksil, menjadikannya gugus lepas yang baik, -OH2+.
Reaksi dehidrasi
| Reaksi dehidrasi | ||
| Reaksi | Persamaan reaksi | |
|---|---|---|
| Konversi alkohol menjadi eter | 2 R-OH → R-O-R + H2O | |
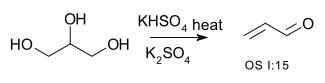
| Konversi alkohol menjadi alkena | R-CH2-CHOH-R → R-CH=CH-R + H2O | contohnya pada konversi gliserol menjadi akrolein:[1] atau dehidrasi 2-metil-1-sikloheksanol menjadi (utamanya) 1-metilsikloheksena [2] |
| Konversi asam karboksilat menjadi anhidrida asam | 2 RCOOH → (RCO)2O + H2O | |
| Konversi amida menjadi nitril | RCONH2 → R-CN + H2O | |
| Penataan ulang benzena dienol | 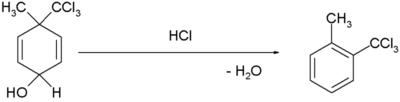 [3][4] [3][4] | |
Beberapa reaksi dehidrasi berjalan dengan cukup rumit. Sebagai contoh, reaksi gula dengan asam sulfat pekat[5] membentuk karbon melibatkan pembentukan ikatan karbon-karbon.[6] Reaksi didorong oleh kondisi yang sangat eksotermis karena asam sulfat bereaksi dengan air, menghasilkan uap mengandung asam sulfat yang berbahaya, karenanya eksperimen sebaiknya hanya dilakukan di lemari asam atau ruangan yang berventilasi baik.
Reaksi dehidrasi adalah reaksi kimia antara dua senyawa yang salah satu produknya adalah air. Misalnya, dua monomer dapat bereaksi di mana hidrogen (H) dari satu monomer berikatan dengan gugus hidroksil (OH) dari monomer lainnya untuk membentuk dimer dan molekul air (H2O). Gugus hidroksil adalah gugus lepas yang buruk, sehingga katalis asam Bronsted dapat digunakan untuk membantu memprotonasi hidroksil untuk membentuk -OH2+. Reaksi sebaliknya, di mana air bergabung dengan gugus hidroksil, disebut hidrolisis atau reaksi hidrasi.
Bahan kimia yang umum digunakan sebagai agen dehidrasi meliputi asam fosfat pekat, asam sulfat pekat, keramik panas, dan aluminium oksida panas.
Reaksi dehidrasi sama dengan sintesis dehidrasi. Reaksi dehidrasi juga dapat dikenal sebagai reaksi kondensasi, tetapi lebih tepatnya, reaksi dehidrasi adalah jenis reaksi kondensasi yang spesifik.
- Contoh Reaksi Dehidrasi
Reaksi yang menghasilkan anhidrida asam adalah reaksi dehidrasi. Misalnya asam asetat (CH3COOH) membentuk anhidrida asetat ((CH3CO)2O) dan air melalui reaksi dehidrasi
2 CH3COOH → (CH3CO)2O + H2O
Reaksi dehidrasi juga terlibat dalam produksi banyak polimer.
- Contoh lain meliputi
- Konversi alkohol menjadi eter (2 R-OH → R-O-R + H2O)
- Konversi alkohol menjadi alkena (R-CH2-CHOH-R → R-CH=CH-R + H2O)
- Konversi amida menjadi nitril (RCONH2 → R-CN + H2O)
- Penataan ulang dienol benzena
- Reaksi sukrosa dengan asam sulfat pekat (demonstrasi kimia )
Lihat pula
Referensi
- ^ H. Adkins; W. H. Hartung (1926). "Acrolein". Org. Synth. 6: 1.
- ^ J. Brent Friesen; Robert Schretzman (2011). "Dehydration of 2-Methyl-1-cyclohexanol: New Findings from a Popular Undergraduate Laboratory Experiment". J. Chem. Educ. 88 (8): 1141–1147. doi:10.1021/ed900049b.
- ^ H. Plieninger; Gunda Keilich (1956). "Die Dienol-Benzol-Umlagerung". Angew. Chem. 68 (19): 618–618. doi:10.1002/ange.19560681914.
- ^ Margaret Jevnik Gentles; Jane B. Moss; Hershel L. Herzog; E. B. Hershberg (1958). "The Dienol-Benzene Rearrangement. Some Chemistry of 1,4-Androstadiene-3,17-dione". J. Am. Chem. Soc. 80 (14): 3702–3705. doi:10.1021/ja01547a058.
- ^ "Salinan arsip". Diarsipkan dari versi asli tanggal 2008-08-27. Diakses tanggal 2008-06-29.
- ^ [1]
Pranala luar
- l
- b
- s
- Pereaksi
- Polimerisasi
- Reaksi adisi
- Reaksi eliminasi
- Reaksi penataan ulang
- Reaksi redoks
- Reaksi substitusi
- Regioselektivitas
- Stereoselektivitas
- Stereospesifisitas
- Daftar reaksi organik